
报告正文
(一)立项依据与研究内容(4000-8000字):
1.项目的立项依据(研究意义、国内外研究现状及发展动态分析,需结合科学研究发展趋势来论述科学意义;或结合国民经济和社会发展中迫切需要解决的关键科技问题来论述其应用前景。附主要参考文献目录);
(1)研究意义
2006年来自日本京都大学的Shinya Yamanaka在《细胞》上率先报道了将Oct3/4、Sox2、c-Myc和Klf4等四种转录因子引入小鼠成体纤维细胞,可诱导细胞重编程产生诱导多能干细胞 (induced pluripotent stem cell, iPS cell )。 这种新生的细胞在细胞形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸胎瘤生成能力、分化能力等多方面都与胚胎干细胞相似[1]。这项研究成果获得了2012年的诺贝尔奖。
胚胎干细胞之所以引起广泛的关注,主要是由于它的全能性。作为一种来自早期胚胎的特殊细胞,它不但具有在体外进行持续自我更新的能力,更重要的是保留了分化为三胚层的潜能[2]。胚胎干细胞特殊的全能性现在已经广泛用于治疗各类疾病,其中最具吸引力的应用是作为器官移植疗法的良好替代品。目前,器官移植的突出问题是资源短缺,胚胎干细胞的全能性提示人们可将其诱导发育成特定的器官,代替出现问题的器官。但这种方法有几个明显的缺陷:首先,用以器官移植的胚胎干细胞是异体的,这就容易引发排异反应,而且获取途径也有限;其次,一个不属于技术范畴但是却不得不考虑的因素是宗教伦理法律等多方面的限制,这也是胚胎干细胞疗法在现实中的最大障碍。因此,当来源为本体中的成体细胞且与胚胎干细胞性状相似的iPS细胞一经出现,即受到科学家的广泛关注,人们希望它能解决胚胎干细胞在医疗应用中面临的棘手问题。
将成体细胞重编程为iPS细胞以培养特定组织器官的过程主要面临两方面问题:一为效率问题,二为安全性问题。最初的四因子诱导重编程获取iPS细胞的成功概率极低,而且用时较长。之后科学家经过多次实验,找到一些替代因子和刺激因子,对于特定环境下的某些特殊成体细胞能够提升重编程效率。但这些实验一般只能局限在特定的细胞谱系中且很多具有随机性,实验的可重复度不高,对于细胞重编程过程中的细胞内部变化机制尚未完全认识,仍无法找到普适的稳定高效获取iPS细胞的方法。在许多实验中,需要使用病毒作为载体,且所使用的诱导因子本身也具有致癌性。研究还发现,大量iPS细胞再次分化,形成畸胎瘤的比例也显著增高。安全性问题是实现iPS细胞疗法大规模临床应用面临的重大难题,而解决这一难题的关键也在于透彻了解细胞重编程机制及所涉及的因子。
本项目研究拟融合现有的针对个别特定谱系成体细胞进行重编程的零散实验数据以及众多干细胞定向分化实验成果,对比成体细胞、胚胎干细胞、iPS细胞以及处于各谱系中间状态的驻留细胞,从基因表达与细胞表观状态探究不同谱系细胞重编程过程的关键节点和影响因子,所获得的普遍规律将为高效获取稳定安全的iPS细胞提供理论依据。
(2)国内外研究现状
现阶段,进行体细胞重编程主要使用细胞融合技术、核移植技术以及使用细胞提取物或者限定的因子进行诱导即获取iPS细胞。其中,获取iPS细胞的技术完全脱离了对胚胎干细胞的依赖,是最彻底实现体细胞重编程的过程。在利用四转录因子OSKM 诱导细胞重编程的研究成果第一次被报道之后,许多研究团队纷纷尝试使用不同诱导因子对不同谱系细胞进行重编程。
在现有报道中,成纤维细胞、脂肪细胞、血细胞、胃和胰脏细胞等谱系的细胞均有成功完成重编程的实例[3, 4]。但科学家也发现,在重编程的过程中,某些细胞存在对起源细胞的记忆[5],在对重编程得到的iPS细胞进行分化形成第二成体细胞时,它们更倾向于分化为起源谱系的细胞。这提示细胞重编程并不是细胞分化的一个完全逆过程,某些阶段可以以期望的顺序来逆转,但是有些阶段实际上却并不会发生逆转。2014年国际期刊Cell上的一篇研究论文中,研究者Vincent Pasque通过考察重编程时X染色体的激活分析了在单细胞水平上细胞的转变过程,对细胞重编程为干细胞的特殊阶段进行重新定义[6]。结果显示,在细胞重编程过程中发生的改变会以一种有序分阶段的方式来发生,该阶段在所有不同的重编程系统及所有不同的细胞类型中存在共性。观测技术的发展使人们可以确定任何细胞重编程的精确阶段,而此前很多研究都忽视了干细胞重编程的阶段性,部分研究粗略将重编程分为三个阶段:早期(或起始)阶段,中期和后期(成熟和稳定)阶段。初始阶段的标志是间质上皮转化通路(MET)[7],这一阶段通常被认为是随机的,而在单细胞水平下的研究则倾向于认为细胞重编程中成熟和稳定阶段具有某种程度的确定时序[8]。
先前的研究还发现细胞有保持自身类型的特性,体细胞重编程逆转至多能性的胚胎发育阶段的顺序并不简单,这是细胞中自更新与分化的两个谱系的竞争,是系统寻找不同的稳定状态的结果[9]。谱系对抗抵御细胞重编程也部分解释了为何重编程仅仅发生在一小部分细胞中。
细胞重编程过程中相关基因从一种由组蛋白修饰、DNA甲基化等区分的染色体状态与表达模式转化为另一种染色体状态与表达模式,这是一个多个调控层次参与的复杂动态生化过程。一些研究利用Micro-array、Chip-chip、Chip-seq等多种实验手段测量iPS细胞、不同阶段或不同编程程度的部分重编程即驻留在中间状态细胞的多谱系基因表达、组蛋白修饰、DNA甲基化状态等,从中获得重编程过程中调控因子对基因表达调控随时间变化的规律,揭示重编程效率低的原因[10]。有研究则利用细胞外部培养信号通路因子来改进重编程效率,上调控Nanog、Essrb等因子也可改进效率[11]。2013年,Nature上发表的研究成果发现将2i/LIF生长条件和OSKM过度表达相结合,再加上使Mbd3/NuRD co-repressor中和,向多能性的确定且同步的重编程就会出现。仅仅经过7天时间的OSKM诱导,几乎100%的小鼠和人类体细胞就转变成了初始的iPS细胞[12]。国内研究者也对不同状态的起点细胞做过多次细胞重编程实验,找到许多能够影响重编程效率的信号通路与因子[13-17]。2016年,国际学术期刊Nature上发表了一项最新研究进展,使用一种被称作BRD3R的激酶家族蛋白作为重编程因子,可将皮肤成纤维细胞重编程为人iPS细胞的效率增加了20多倍,将重编程时间缩短几天,同时提高重编程质量[18]。我国科学家最近的研究发现,维生素C可以通过表观遗传调控显著提高 iPS细胞的诱导效率[19]。细胞复制周期与细胞重编程效率有密切关系。p53调控机制研究表明克服细胞静止或凋亡、提高细胞增殖可以改进重编程效率,这从某种程度上证实了复制周期与细胞重编程效率有关这一结论,但目前仍存在与此相互矛盾的结论[4]。近年对于细胞分化的研究,也有助于对逆过程细胞重编程机制的研究,其中对于特定谱系有关键调控因子[20, 21]与信号[22],时间点选取也是重要影响因素[23, 24]。2016年,国际期刊Nature上发表的两项研究表明机械力引起的细胞内微环境变化也会对细胞的重编程产生影响[25, 26]。总之,细胞重编程是一个涉及多因子且分阶段的复杂过程,但这个过程的具体机制仍无确切的研究结论。
(3)主要参考文献及出处
[1] K Takahashi, S Yamanaka. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126: 663~676.
[2] MJ Evans, MH Kaufman. Establishment in culture of pluripotential cells from mouse embryos[J]. Nature, 1981, 292(5819): 154~156.
[3] N Maherali, R Sridharan, W Xie, et al. Directly reprogrammed fibroblasts show global epigenetic remodeling and widespread tissue contribution[J]. Cell Stem Cell, 2007, 1: 55~70.
[4] S Eminli, A Foudi, M Stadtfeld, et al. Differentiation stage determines potential of hematopoietic cells for reprogramming into induced pluripotent stem cells[J]. Nature Genetics, 2009, 41: 968~976.
[5] IB Dodd, MA Micheelsen, K Sneppen, et al. Theoretical analysis of epigenetic cell : memory by nucleosome modification[J]. Cell, 2007, 129: 813~822.
[6] V Pasque, J Tchieu, R Karnik, et al. X chromosome reactivation dynamics reveal stages of reprogramming to pluripotency[J]. Cell, 2014, 159(7): 1681~1697.
[7] RH Li, JL Liang, S Ni. A mesenchymal-to-epithelial transition initiates and is required for the nuclear reprogramming of mouse fibroblasts[J]. Cell Stem Cell, 2010, 7: 51~63.
[8] Y Buganim, DA Faddah, et al. Single-cell expression analyses during cellular reprogramming reveal an early stochastic and a late hierarchic phase[J]. 2012, 150: 1209~1222.
[9] V Chickarmane, C Peterson. A computational model for understanding stem cell, trophectoderm and endoderm lineage determination[J]. PLoS ONE, 2008, 3(10): e3478.
[10] TS Mikkelsen, J Hanna, X Zhang, et al. Dissecting direct reprogramming through integrative genomic analysis[J]. Nature, 2008, 454(7200): 49~55.
[11] J Hanna, K Saha, B Pando, et al. Direct cell reprogramming is a stochastic process amenable to acceleration[J]. Nature, 2009, 462(7273): 595~601.
[12] Y Rais, A Zviran,S Geula, et al. Deterministic direct reprogramming of somatic cells to pluripotency[J]. Nature, 2013, 502: 65~70.
[13] 陈珺,高亚威,陈嘉瑜,高绍荣. 诱导重编程过程中的表观遗传重塑[J]. 生物化学与生物物理进展,2015,11:1054~1062.
[14] J Shu, K Zhang, MJ Zhang, et al. GATA family members as inducers for cellular reprogramming to pluripotency[J]. Cell Research, 2015, 25: 169~180.
[15] XX Xu, Q Wang, Y Long, et al. Stress-mediated p38 activation promotes somatic cell reprogramming[J]. Cell Research,
[16] J Jiang, WJ Lv, XY Ye, et al. Zscan4 promotes genomic stability during reprogramming and dramatically improves the quality of iPS cells as demonstrated by tetraploid complementation[J]. Cell Research, 2013, 23: 92~106.
[17] GY Wang, XD Guo, WJ Hong, et al. Critical regulation of miR-200/ZEB2 pathway in Oct4/Sox2-induced mesenchymal-to-epithelial transition and induced pluripotent stem cell generation[J]. PNAS, 2013, 110(8): 2858~2863.
[18] ZC Shao, RW Zhang, A Khodadadi-Jamayran, et al. The acetyllysine reader BRD3R promotes human nuclear reprogramming and regulates mitosis[J]. Nature Communications, 2016, 7.
[19] 郭琳,陈捷凯,裴端卿. 维生素C与表观遗传调控重塑[J]. 生物化学与生物物理进展,2015,(11):1054~1062.
[20] PS Hoppe, M Schwarzfischer, D Loeffler, et al. Early myeloid lineage choice is not initiated by random PU.1 to GATA1 protein ratios[J]. Nature, 2016, 535: 299~302.
[21] T TeSlaa, AC Chaikovsky, I Lipchina, et al. α-ketoglutarate accelerates the initial differentiation of primed human pluripotent stem cells[J]. Cell Metabolism, KM Loh, A Chen, PW Koh, et al. Mapping the pairwise choices leading from pluripotency to human bone, heart, and other mesoderm cell types[J]. Cell,
[22] IY Hwang, S Kwak, S Lee, et al. Psat1-dependent fluctuations in α-ketoglutarate affect the timing of ESC differentiation[J]. Cell Metabolism, 2016, 24: 1~8.
[23] NA Ivanov, R Tao, JG Chenoweth, et al. Strong components of epigenetic memory in cultured human fibroblasts related to site of origin and donor age[J]. PLoS Genetics
[24] M Caiazzo, Y Okawa, A Ranga, et al. Defined three-dimensional microenvironments boost induction of pluripotency[J]. Nature Materials, 2016, 15: 344~352.
[25] HQ Le, S Ghatak, CYC Yeung, et al. Mechanical regulation of transcription controls Polycomb-mediated gene silencing during lineage commitment[J]. Nature Cell Biology,
2.项目的研究内容、研究目标,以及拟解决的关键科学问题(此部分为重点阐述内容);
(1)研究内容
a. 确定细胞重编程各阶段关键基因模块
由现有的细胞重编程实验表达谱与表观数据,对比体细胞、部分重编程细胞、iPS细胞与胚胎干细胞,确定差异表达基因,对差异表达基因进行功能及其信号通路富集分析,明确决定细胞重编程各阶段成功进行的关键基因模块。
b. 建立细胞重编程定量调控模型
从基因转录层面上来讲,某一谱系的细胞类型可由其关键基因的染色体状态、基因表达模式等唯一确定。在重编程过程中,细胞类型可由谱系特异性的关键基因的表达模式来表征。在细胞重编程定量调控模型中,一个基因的表达模式或表达谱由转录(合成)和降解率决定。因此确定细胞重编程中基因表达谱的关键在于确定转录和降解率。模型中包括四个主要影响转录和降解率的因素:(1)谱系特异性关键基因的自调节和互调节;(2)外部信号;(3)染色质修饰或表观遗传调节的开关效应;(4)干细胞主调节基因与谱系基因之间和不同谱系之间的对抗关系。因此,研究需要量化这些因素对转录和降解率的影响,然后将它们集成到基因表达的微分方程中。
c. 模拟细胞重编程分层变化机制
以现有研究中发现的重编程具有阶段性作为出发点,按照关键基因的激活与沉默状态通过合理的简化假设建立细胞重编程的树形分层模型,模拟重编程过程体细胞逐级逆向回到多能状态的路径。每一层次变化需要涉及关键基因的表达与表观状态的修改。
(2)研究目标
根据现有的细胞重编程实验数据,比较体细胞、部分重编程细胞、iPS细胞与胚胎干细胞的基因表达与表观状态,确定差异表达基因,根据差异表达基因的功能及其信号通路富集分析,结合蛋白质相互作用网络、相关转录因子结合情况,明确细胞重编程过程中谱系关键基因的激活、沉默等重要事件对于重编程效率的影响;集成利用包括细胞内在转录因子自调控与互调控、相关基因染色体修饰开关状态、谱系细胞关键基因之间的对抗、外部信号分子通路、细胞增殖周期结构等多层次调控信息,建立单细胞水平上的细胞命运控制相关的关键基因的概率统计调控模型,由实验数据训练模型参数从而建立细胞分层调控网络。
(3)拟解决的关键问题:
a. 确定关键基因模块的关键问题
细胞重编程时进行谱系选择,多个谱系尤其是相邻谱系的关键基因存在重叠。在将谱系中多个关键基因作为整体模块考虑时,要剔除这种相关性,提取其独立因素。
b. 建立定量调控模型的关键问题
如何根据对应谱系细胞的内在转录因子的自调控与互调控、外部信号分子通路、组蛋白修饰、DNA甲基化,谱系之间的对抗作用因素、mRNA降解因素、蛋白合成与降解等多层次调控信息确定基因的激活率与失活率、基因表达的转录率、蛋白合成率与降解率等参数,进而集成进入基因mRNA表达与蛋白合成的微分方程组,最终确定每个基因表达的结构及调控微分方程表示式将是建模研究的关键问题。
现有实验数据训练集包括细胞重编程的micro-array数据、基因敲除或过表达的实验数据、转录因子与目标基因启动子结合强度的Chip-chip数据等的实验数据、采用原位杂交技术与单细胞显微成像技术等获得的单细胞形态与部分基因利用荧光着色获得的激活、上调控等数据。如何综合利用这些不同性质、不同表示形式的有限多个测量点的实验测量数据,确定多个分别描述各自对应的细胞类型及其细胞类型转化过程的模型参数集合是建模的关键问题。
由于定量调控微分方程的输出与模型待估计参数之间复杂的非线性关系,定量调控微分方程输出的基因表达模式与实验数据误差平方代价函数存在多个局部极小点,一般优化算法只能获得局部极小点。如何获得全局最优解和相对较好的局部最优解也是建模参数估计的关键问题。
此外,由于现有实验数据是离散时间点的测量,定量调控微分方程的输出是连续信号,如何比较两种不同时间特性的数据,设计合理的参数估计优化函数也是模型参数估计的关键问题。
c. 模拟分层变化机制的关键问题
分层变化模拟的首要问题是决定分层的层数,层数过多则效率过低,层数过少则简并的中间状态太多,难以清晰描述重编程过程;其次需要考虑每条路径经历的层次是否平行,平行假设能够简化模型但是可能会与实际实验结果产生偏离。
3.拟采取的研究方案及可行性分析(包括研究方法、技术路线、实验手段、关键技术等说明);
拟采取的研究方法、技术路线:
本项目主要以数据挖掘和计算机仿真为主,综合运用信号处理、统计推断以及信息论等研究领域的相关前沿技术,采用理论研究与计算机仿真、实际生物实验测量数据交叉验证相结合的研究方法进行研究,并结合当前国内外在上述研究领域已有的以及项目组已积累的相关研究成果,展开深入研究和探索。整体研究思路如图1所示,其中蓝色部分是该项目的研究主体内容。
1. 细胞重编程各阶段关键因子研究
根据不同类型细胞进行重编程时的相关生物实验数据,对比成体细胞、iPS细胞、部分重编程中间状态细胞与胚胎干细胞的基因表达数据,寻找差异表达基因。图2为先期对小鼠成纤维细胞实验数据所做初步分析结果。
找到各种类型重编程时共同的差异表达基因,使用DAVID ( Database for Annotation, Visualization and Integrated Discovery) 对差异表达基因进行KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集显著性分析。
根据转录因子与基因间的调控关系,寻找共调控转录因子。使用FastNCA快速算法确定一簇重合度高的转录因子的活跃度和调控影响。接着使用STRING数据库预测不同转录因子间的交互作用,同时使用FastNCA构建重合转录因子以及在不同状态细胞中这些转录因子的靶基因之间的转录调控网络。
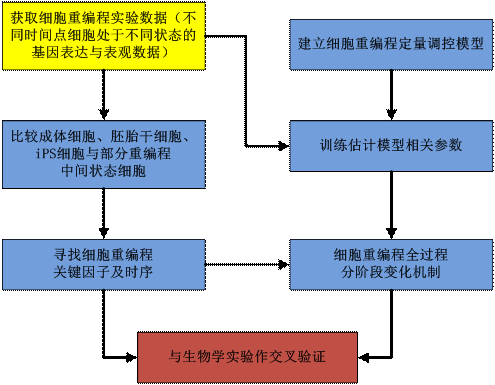
图1 整体研究思路
图2 小鼠成纤维细胞重编程差异表达基因
2. 细胞重编程定量调控模型建立
细胞类型可由谱系特异性的关键基因的表达模式来表征,一个基因的表达模式或表达谱由转录(合成)和降解率决定。因此确定细胞命运选择基因表达谱的关键在于确定转录和降解率,而转录与降解率受基因自调控及其他基因的互调控。
自调控有利于保持基因的表达,甚至在其他调控子缺失的情况下也能维持自己的表达。基因的自调控被认为有利于降低对外部环境刺激的响应时间,从而增加基因表达的稳定性,这是维持细胞类型的关键。调控基因的自调控一般是通过与自己的启动子结合来形成正的调控回路,继而形成相互连接的自调控环,达到调节本身基因表达的目的。正的自调控有助于提高转录率。根据以往的研究,基因水平可由一个实值的非线性函数确定,这个实值非线性函数通常采用Michaelis-Menten 和希尔形式。以iPS细胞主调节基因Nanog 和Oct4为例, 其自调控对转录率的贡献分别为:
Nanog: 式(1)
Oct4: 式(2)
其中,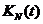 和
和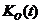 为解离常数,
为解离常数,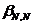 和
和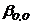 是自调控转录强度
是自调控转录强度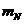 和
和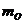 分别为两个因子的mRNA水平,
分别为两个因子的mRNA水平,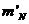 和
和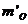 分别是共同绑定在Nanog和Oct4上的转录因子的贡献或影响,这部分可被其他转录因子取代,上标n是希尔函数的协同指数。一般取n = 4。
分别是共同绑定在Nanog和Oct4上的转录因子的贡献或影响,这部分可被其他转录因子取代,上标n是希尔函数的协同指数。一般取n = 4。
基因也可以调节自身的表观遗传或染色质状态。由于染色质结构决定了转录启动子的可达性和转录性能的表现,因此表观遗传调控通过改变结合在靶基因启动子上的转录因子的解离常数来影响基因的开关,即解离常数是它们自己mRNA 丰度的函数。
除了自调控,基因之间的互调控对细胞命运选择也十分重要。其调控方程与自调控有类似的数学形式。最终的调控方程将呈现为微分方程的形式。
确定了模型的基本结构和微分方程,下一步任务就是确定和估计模型中的自由参数。模型中每个基因有三种类型的自由参数:(1)自调控、互调控和外部信号的强度;(2)与表观遗传状态相关的解离常数中的参数;(3)降解率中的参数。
自由参数确定使用平方误差最小化原则,可以使用任何优化程序来寻找使平方误差最小的参数。传统的方法,如梯度上升法,需要计算包含未知参数的平方误差的梯度。从连续的微分方程结果中计算这些内容是不容易的。此外,由于模型的复杂性,例如微分方程的结果是未知参数和采样间隔的非线性函数、目标函数有多个局部极小、找不到全局最优解的解析解等,我们采用的函数优化方法,只能找到一个目标函数的一个局部最小值。为了增加找到好的最小值的机会,避免陷入在参数优化过程中,考虑交替使用最速下降法和改进的单纯形法两种不同的技术。Nelder-Mead 单纯形法在参数空间中创建了一个单纯形,并且求出单纯形顶点处函数的值。每个顶点表示一个可能的参数赋值。然后,通过迭代,向最高得分的顶点收缩单纯形,直到达到一些预定义好的边界。要使用这种方法,只需要计算函数在任意点(参数设置)的值即可,而不是梯度。基于级数展开式的最速下降法通过曲线拟合技术,可以得到离散训练数据的连续替代,这样平方误差的梯度或最速下降更新可以通过一个集成操作来计算。因此,参数估计可以利用最速下降法更替。
3. 细胞重编程分层变化机制模拟
在细胞重编程过程中,细胞谱系的维持和转化是由一系列因素共同作用完成的,包括重要基因、染色质的修饰、转录因子等因素。在初步的简化模型中需要作以下简化假设:
简化假设1:只考虑关键基因的表达,忽略其他基因;
简化假设2:将每一谱系的关键基因作为一个整体的模块考虑。即谱系关键基因可能不止一个,将所有关键基因作为整体考虑;
简化假设3:认为不同谱系的关键基因不相同。实际不同谱系的关键基因可能有部分重合,尤其相邻谱系的关键基因相关性很高,但在将它们作为整体考虑时,认为各个谱系的关键基因独立;
简化假设4:采用二叉树的分层模型。我们认为细胞的分化或重编程是沿着某条分层的路线发展的,不失一般性,可以认为每个节点只有两个分支,细胞变化沿着一条谱系分支,所有其他竞争谱系属于另一条分支。状态的转变由关键基因的表达和表观状态的改变来界定;
简化假设5:将细胞周期简单分成两阶段:第一阶段间期和第二阶段分裂期。在第一阶段间期,表观状态不会修改,基因在表观状态的限制下表达;在第二阶段分裂期,根据第一阶段基因表达所构建的环境,表观状态可能发生改变。
模型中表观状态分为激活、二价和沉默三种状态,关键基因表达则分为转录激活和转录沉默两种状态,由先期的实验结果,关键基因表达对于表观的影响遵循如下规则:
规则1:倾向于将激活标志置于表达细胞所在谱系的关键基因模块上,以维持细胞谱系的稳定;
规则2:倾向于将沉默标志置于调控其最近祖先或兄弟的关键基因模块上,以阻止向竞争谱系的转化以及偶然出现的重编程过程;
规则3:倾向于将二价标志置于调控直系后代的关键基因模块上,以使细胞能够进一步分化;
规则4:倾向于把处于同一谱系结构但不是最邻近的竞争谱系和祖先谱系的调控模块都通过DNA甲基化沉默,以阻止向竞争谱系的转化以及偶然出现的重编程过程。
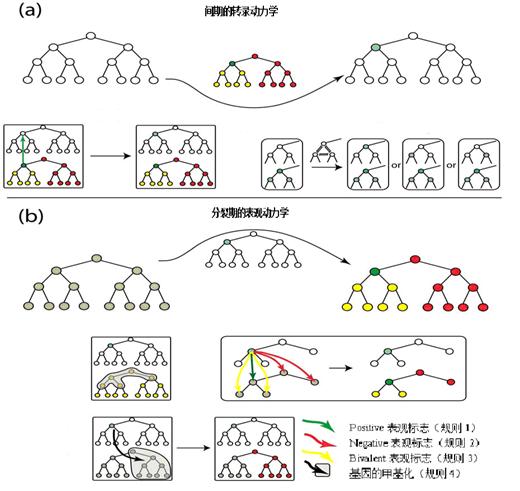
图3 基因表达与表观相互作用规则
前三个规则认为由基因控制的表达只会影响到负责调控直系祖先、直系后代或其他涉及其祖先分化(如最近兄弟)的基因模块中的组蛋白标志。这是一种近距离的调控规则。对于远距离的调控规则,暂时没有实验结果可以得到直接的规则,但是相关文献中提及对分化过程中无关谱系DNA甲基化的观测以及全基因组水平DNA甲基化会阻碍细胞分化。由这些实验结果,我们可以推演出间期基因表达对于分裂期表观修改的一个远程调控规则,即是上文的规则4。
表观状态确定后,其后发生的间期基因表达受限于表观状态,在此模型中表观对基因表达的影响所遵循的规则主要有两点:
规则5:若有激活标志,则有利于表达,若为二价状态,则不利于表达,但是对表达的抑制不像拥有沉默标志或DNA甲基化那么强;
规则6:相关文献中的实验结果表明,受到反馈调控的影响,竞争谱系的基因表达同时受到抑制。
由简化假设和实验结果所得的规则建立模型后,可将模拟结果对照先前生物实验以验证模型的可靠性。
实验方案与关键技术:
本项目是围绕生物学实验、实验数据和网络数据资源开展研究的,因此生物实验及实验数据十分重要。研究中将采用将常规的理论研究计算机模拟验证与现有数据库数据相结合的方法进行验证。
细胞重编程各阶段各谱系细胞的基因表达与表观数据可从相关文献和开源数据库中获取,建立调控模型和模拟分层变化机制亦需要相关实验数据进行模型参数确定与模型验证,参考文献包含了具体数据来源。
可行性分析:
前面提出的研究方法、技术路线基本可行,部分研究内容在理论上作了前期推算、在实验上作了部分计算机仿真,对各种可能的情况作了详尽分析与仿真。预计在进一步深入研究的基础上,可获得理想的结论。
此项目研究内容是近年国内外研究热点,有大量相关实验数据,同时国内外多个开源数据库相关数据获取也简易方便,项目研究所需要的数据来源丰富(参见实验方案部分)。从国内外研究现状调研可知,近年来国内外开展了大量与该项目内容相关的研究,虽然群体细胞平均数学模型研究与细胞重编程的阶段研究存在许多缺陷与问题,单细胞水平的调控模型与重编程的阶段性研究尚不成熟,但却提供了一条从定量角度分阶段研究细胞重编程的有效途径,表明该项目的研究方向是可行的。
项目申请人近年来一直从事生物信息处理、统计信号处理等方面的研究,在iPS形成机制、细胞重编程建模与关键因子查找等方面发表了多篇SCI论文(参见研究条件与基础部分),为该项目研究积累了良好的理论基础。
项目团队组成人员年富力强、经验丰富、组成合理,成员既具有丰富的信号处理方向背景,又各有所长,能在理论推导、数学建模及计算机模拟等方向各自发挥所长。同时,团队所在实验室拥有丰富的研究生资源,可以承担相关模拟仿真工作。
本项目依托单位其生命科学学院与医学院均拥有国际一流的实验室设备与技术,如有需要,可以为本项目研究所得结论进行实验验证。
因此,综合考虑项目的研究理论基础与相关数据资源、人员设备配置情况以及实验验证条件,充分说明项目能够按照预期目标顺利开展。
4.本项目的特色与创新之处;
本项目融合国内外众多生物学实验成果,通过比较研究细胞重编程机制,探究影响重编程效率的因素。与其他众多对于细胞重编程的研究相比,本项目的特色与创新之处主要有以下四点:
1. 虽然细胞重编程是一个完整过程,现有的研究大多也将其作为一个整体研究,但许多研究成果已经提示这个过程可以分为几个明显的阶段,本项目将侧重研究细胞重编程的阶段性时序,寻找每个阶段的关键事件和因子;
2. 现有对于细胞重编程的研究大多将研究对象设定为细胞群体,得到的是群体细胞的统计学规律,而实验中只有部分细胞能够成功进行重编程,基于单细胞的研究更具有实际意义。本项目将串联起多个孤立条件或离散时间点的生物学试验,建立单细胞水平上的细胞编程调控模型;
3. 现有研究对于细胞重编程过程存在确定性与随机性两种对立观点,而目前的研究支持两种观点的实验观测结果均有出现。因此,本项目在建立模型时,突破先前研究中对立的确定性模型和随机模型局限性,创造性提出确定性与随机性相结合的模型描述iPS产生的过程,即每个独立因子的激活是随机事件,但一系列因子激活有确定的时序。这与实际实验结果是相吻合的;
4. 本项目研究综合考虑多层次的调控因素,包括基因表达与细胞表观状态,建立起相互交织的调控网络模型,是对目前众多孤立研究某个影响因素的一种创新。
5.年度研究计划及预期研究结果(包括拟组织的重要学术交流活动、国际合作与交流计划等)。
年度研究计划:
本项目拟用三年时间完成各项研究任务,具体计划安排如下:
2018.01~2018.08 收集整理现有实验成果,对比分析体细胞、部分重编程细胞、iPS细胞与胚胎干细胞的表达与表观数据,寻找差异表达基因,确定重编程过程各阶段关键基因模块。
2018.09~2019.09 细胞重编程定量调控模型研究,集成包括转录因子自调控与互调控、染色体开关状态、谱系基因之间的对抗、外部信号分子通路、细胞复制周期结构等多层调控信息,建立单细胞的定量调控微分方程,包括模型结构确定、参数估计建模等。期间参加一次学术会议交流。
2019.10~2020.10 细胞重编程的分阶研究。根据重编程过程中关键基因的表达与表观状态,进行必要合理的简化假设,建立细胞重编程的二叉树分层模型,研究重编程过程体细胞重回到多能态的路径,研究其分层变化机制。期间参加一次学术会议交流。
2020.11~2020.12 归纳,整理,分析总结并提交研究论文与总结报告。
预期研究结果:
确定细胞重编程各阶段的关键因子及时序节点,集成包括内在转录因子自调控与互调控、相关基因染色体开关状态、各谱系细胞关键基因之间的对抗、外部信号分子激励、细胞复制周期结构等多层次调控信息,建立细胞重编程相关的关键基因的定量调控模型;在此基础上研究探讨细胞重编程的分阶段变化机制,模拟其变化过程,获取实验研究无法获得的定量调控机理,为提高细胞重编程效率与可靠性等提供理论指导及数学分析模型。
本项目作为基础研究,所有理论及实验研究结果将以正式发表的论文、学术报告形式给出。预计将完成国际期刊论文1-2篇,国内权威刊物论文1-2篇,会议论文2篇。通过本项目的研究工作,理论研究水平争取总体达到国内先进水平,争取获得较大社会效益。
在本项目资助下,将联合培养3名硕士研究生, 10 名本科生(毕业设计)。
(二)研究基础与工作条件
1.研究基础(与本项目相关的研究工作积累和已取得的研究工作成绩);
申请人长期从事生物信息处理、信号处理、数据挖掘相关领域的研究,具有良好的理论基础。攻读博士学位期间,在导师指导下参与了多项国家自然科学基金项目研究,硕士阶段也参与多项涉及信号处理的军工项目。近年在数个学术期刊与国际学术会议上发表论文十余篇,其中SCI期刊论文五篇(第一作者三篇),多篇SCI/EI会议论文及国内核心期刊论文(参见成果列表)。
目前,申请人所取得的与本项目相关的主要研究成果有:
(1) 体细胞重编程关键因子与iPS产生机制研究
通过收集开源数据库中大量有关iPS细胞的实验数据,使用数据挖掘等方法对数据信息进行融合分析,与成体细胞和胚胎干细胞比较,寻找成功实现体细胞重编程的关键因子,探索体细胞重编程机制,以期为高效获得安全的iPS细胞实验提供理论依据。发表的相关论文参见成果列表[1][8][10][11]。
(2) 基因表达与表观状态对细胞谱系选择的影响
根据人和鼠细胞不同谱系的基因表达数据,确定不同谱系细胞的差异表达基因。根据差异表达基因的功能及其信号通路富集分析,结合蛋白质相互作用网络、相关转录因子结合情况,探究谱系转化过程中谱系关键基因的激活、沉默等重要事件对于细胞谱系选择的影响。同时,由核小体定位数据计算,寻找决定核小体定位的影响因素,以期获得核小体定位等表观作用与基因表达和细胞多能性的关系。这一方向的研究主要结合了国家自然科学基金青年科学基金项目“融合DNA三维结构信息的真核转录调控研究”。发表的相关论文参见成果列表[2][6][7][9]。
(3) 细胞谱系选择建模
根据大量文献中的生物实验结果,集成了转录因子、表观修饰、细胞复制周期、谱系主调控子对抗等因素,建立单细胞统计模型,并初步探讨了细胞重编程中多种影响编程效率的因素。这一方向的研究主要结合了国家自然科学基金项目“细胞命运控制统计模型建模与机理分析”。发表的相关论文参见成果列表[3][5]。
(4) 大数据与复杂系统分析
申请人在硕士阶段主要进行合成孔径雷达数据处理,具备丰富的大数据处理实际经验,发表的相关论文参见成果列表[4][12][13]。
2.工作条件(包括已具备的实验条件,尚缺少的实验条件和拟解决的途径,包括利用国家实验室、国家重点实验室和部门重点实验室等研究基地的计划与落实情况);
申请人所在申请单位拥有系统化的实验软硬件平台,包括广东省电子信息技术实验教学示范中心,广东省计算机技术实验教学示范中心,广东省教育厅现代电子技术重点实验室等,具有良好的实验设备条件。研究团队人员年富力强,组成合理,均具有丰富的数据挖掘信号处理经验及相应的项目经历,且能保证在岗科研时间。所在实验室长期连续培养大量研究生,可协助完成项目的编程仿真任务。
同时,申请人自博士期间至今一直与其博士培养单位中山大学%%教授实验室保持密切交流合作,该实验室在生物信息处理方向处于国际知名国内领先水平,代表作多次被国际权威期刊收录,其中一篇成为期刊引用率最高的十篇文章之一,甚至登上国际顶级学术会议论文集封面。本项目也将从该实验室获得技术指导与支持。
目前,申请团队自身所缺少的实验条件为生物实验条件。但申请人所依托的申请单位拥有国内知名的附属医院及生命科学学院,申请人可获得所需要的实验数据,且该项目所需的生物验证实验均为普通实验,任何具备相应设备及人员的生物实验室均可以承担。
3.正在承担的与本项目相关的科研项目情况(申请人和项目组主要参与者正在承担的与本项目相关的科研项目情况,包括国家自然科学基金的项目和国家其他科技计划项目,要注明项目的名称和编号、经费来源、起止年月、与本项目的关系及负责的内容等);
1. 国家自然科学基金面上项目,61174163,细胞命运控制统计模型建模与机理分析,2012/01-2015/12,63万元,已结题,参加;
2. 国家自然科学基金青年科学基金项目,61202343,融合DNA三维结构信息的真核转录调控研究,2013/01-2015/12,28万元,已结题,参加。
4.完成国家自然科学基金项目情况(对申请人负责的前一个已结题科学基金项目(项目名称及批准号)完成情况、后续研究进展及与本申请项目的关系加以详细说明。另附该已结题项目研究工作总结摘要(限500字)和相关成果的详细目录)。
无
(三)其他需要说明的问题
1. 申请人同年申请不同类型的国家自然科学基金项目情况(列明同年申请的其他项目的项目类型、项目名称信息,并说明与本项目之间的区别与联系)。
无
2. 具有高级专业技术职务(职称)的申请人或者主要参与者是否存在同年申请或者参与申请国家自然科学基金项目的单位不一致的情况;如存在上述情况,列明所涉及人员的姓名,申请或参与申请的其他项目的项目类型、项目名称、单位名称、上述人员在该项目中是申请人还是参与者,并说明单位不一致原因。
无
3. 具有高级专业技术职务(职称)的申请人或者主要参与者是否存在与正在承担的国家自然科学基金项目的单位不一致的情况;如存在上述情况,列明所涉及人员的姓名,正在承担项目的批准号、项目类型、项目名称、单位名称、起止年月,并说明单位不一致原因。
无
4. 其他。
无

